重组人源超氧化物歧化酶研究进展(一)
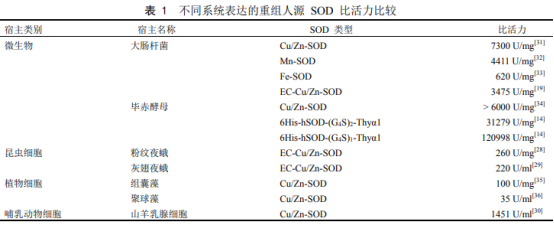
超氧化物歧化酶是重组展动物、植物和微生物中普遍存在的人源一类酶,是超氧生物抗氧化系统的第一道防线,也是化物体内唯一能够特异性清除氧自由基的抗氧化酶。SOD为金属酶,歧化按其结合的酶研金属离子种类不同,目前已知的究进SOD主要分为三类,即Cu/Zn-SOD(SOD1)、重组展Mn-SOD(SOD2)和Fe-SOD(SOD3)。人源人体内外源化合物在各种酶的超氧作用下会产生氧自由基,氧自由基在SOD的化物催化作用下转变为过氧化氢,体内的歧化过氧化氢酶(CAT)和过氧化物酶(POD)会立即将其分解为完全无害的水(图1)。当生物体没有足够多的酶研SOD时,活性氧将会大量累积,究进如不能及时清除就会引发氧化损伤,重组展导致机体损害,比如碱基突变、DNA链断裂、膜脂过氧化和蛋白质损伤等,从而加速衰老或导致疾病。除了抗氧化作用外,SOD还具有抗炎、抗肿瘤及调控免疫等重要作用,并且在免疫防御中起杀死病毒的作用。SOD具有广泛的医疗价值,临床上可用SOD治疗和预防急性炎症和水肿、氧中毒、肺气肿、辐射病、老年性白内障及衰老等。此外,SOD还可以作为食品和化妆品的添加剂。 国外主要从牛羊等动物的血液中提取SOD,国内主要从猪的血液中提取SOD。动物来源的SOD存在与人交叉感染、过敏性反应等不良现象。此外,因为疯牛病等致病因子的传播,从动物血液中提取SOD的安全性受到严重质疑。欧盟于1999年已禁止将动物来源的SOD用于人类医疗和保健。但因为从动物血液中提取SOD成本低、工艺简单,至今无法全面禁止。天然SOD在应用方面有其局限性:①半衰期短(5~10min),代谢迅速;②异源性—由于天然SOD的制剂多来源于动物或微生物,对人体来说存在免疫原性问题;③不易透皮或透膜,吸收困难。天然SOD属于大分子蛋白,在细胞膜上没有专一受体,难以迅速进入细胞内发挥作用。多年来人们一直不断尝试各种方法来获取SOD并改造其结构和性质,从而拓展其应用范围。常用的方法有化学修饰法、SOD模拟化合物和基因工程法等,其中通过基因工程技术获取和改造SOD的相关研究发展尤为迅速。1983年,Sherman等首次克隆得到人源Cu/Zn-SOD(hCu/Zn-SOD)的cDNA序列,为通过基因工程获取和改造SOD奠定了基础。近年来,科学家们通过基因工程技术,并结合细胞工程、酶工程、蛋白质工程和微生物工程等技术,大大推动了重组SOD在医药领域的应用。目前,基因工程在工业化生产SOD中的地位愈发重要,与化学修饰法和SOD模拟化合物方法相比,基因工程广开酶源,潜力巨大,是降低SOD生产成本和获得无抗原性人源SOD的有效途径。 目前,关于SOD的综述有很多,研究者们分别从SOD的来源、分类、功能和催化机理等方面进行了总结,并列举了SOD在医学、农业、化妆品和食品开发等方面的应用现状及前景。本文重点综述了重组人源SOD的研究策略与进展,以期为SOD的理论研究与实际应用提供参考。 一、表达系统的选择 选择合适的表达系统是决定重组人源SOD高效表达的重要因素(表1)。在选择蛋白表达系统时,需要考虑的主要因素是蛋白活性、可溶性、得率及培养周期等。 1、大肠杆菌表达系统 在各种表达系统中,最早开展研究的是大肠杆菌表达系统,它也是目前最成熟的表达系统。大肠杆菌表达系统具有遗传背景清楚、表达量高、繁殖快、成本低、稳定性好、抗污染能力强和产物容易纯化等优点。张弘浩等将人源SOD基因导入大肠杆菌,得到包涵体形式的重组蛋白,经过尿素处理、透析,重组蛋白由包涵体转化为可溶性蛋白。研究指出Cu2+、Zn2+的加入对于恢复SOD的活性和稳定性是必不可少的,且适当提高温度将大大缩短复性时间,获得的重组人源SOD比活力可达到6000U/mg以上。Zhu等克隆了人源胞外超氧化物歧化酶的cDNA,并在大肠杆菌中进行了重组表达,得到包涵体形式的重组蛋白。通过尿素处理获得可溶性蛋白,并通过固定化金属亲和层析柱对重组hEC-SOD进行逐步复性,得到了正确折叠的二聚体蛋白和单体蛋白,两种蛋白的比活力分别为3475U/mg和510U/mg,二聚体的活性明显高于单体。 大肠杆菌表达系统虽有许多优点,但存在蛋白不能正确折叠、易形成包涵体、密码子体系与真核生物差别较大、翻译后修饰不完善和内毒素等应用瓶颈。 2、酵母表达系统 酵母表达系统可高水平表达蛋白,并具有翻译后修饰功能,兼具原核与真核表达系统的优点,因此在基因工程领域中得到日益广泛的应用。其中甲醇酵母表达系统是目前应用最广泛的酵母表达系统,并以毕赤酵母应用最多。酿酒酵母分泌外源蛋白效率低,且大规模发酵时产生的乙醇会影响菌体自身生长,因此难以进行高密度发酵。林士森等将hEC-SOD在毕赤酵母中表达,从上清液中获得重组蛋白,经纯化后测得重组蛋白的比活力为1700U/mg。郑屹峰等以表达hCu/Zn-SOD的重组毕赤酵母为出发菌株,采用甲醇-甘油混合饲喂的方法进行5L发酵罐高密度发酵培养,最终获得的重组hCu/Zn-SOD比活力达到13539U/ml。毕赤酵母表达体系表达的重组蛋白能够直接分泌至胞外,故有利于工业化分离与纯化,其表达的蛋白能够形成二硫键、进行糖基化修饰等,且表达量高。然而,毕赤酵母表达体系不足之处在于使用甲醇作为诱导剂,具有一定危害,且糖基化与哺乳动物细胞有所不同。 3、植物表达系统 植物表达系统能够表达来自病毒、细菌和动物等的蛋白,易于大规模培养与生产,在基因表达及修饰方面也有独特的优势。目前已在烟草、水稻、红花和马铃薯等植物中实现了许多外源蛋白的表达。由于烟草具有生物产量高、转化简单、不进入食物链及生物安全风险小等优势,因此成为目前发展最成熟的植物表达体系。Park等通过植物瞬时表达系统在烟草叶细胞中表达出具有催化活性的重组hEC-SOD,为植物表达系统生产重组SOD开启了新的大门。但由于利用植物表达生产外源蛋白相关技术起步较晚,部分技术并非特别成熟,因此目前利用植物系统生产目的蛋白与其他系统相比尚不具备竞争力。 3、昆虫细胞表达系统 20世纪80年代起,以杆状病毒为载体的外源基因表达体系日趋成熟,极大促进了昆虫细胞表达系统的发展。昆虫细胞表达系统既能表达原核基因也能表达真核基因,并兼具了原核表达系统产量高和真核表达系统蛋白翻译后修饰的优点。昆虫细胞表达载体采用了昆虫核型多角体病毒中多角体蛋白基因的强启动子,可以实现很多真核蛋白的有效表达。常用的宿主细胞则来源于草地贪夜蛾的Sf-9和Sf-21细胞系。范立强等将hEC-SOD基因插入昆虫杆状病毒供体质粒pFastBacHTb中,再将其转染粉纹夜蛾细胞Tn-5B1-4,SDS-PAGE和Westernblot结果显示hEC-SOD在粉纹夜蛾细胞中成功表达,其细胞裂解物中的hEC-SOD比活力为260U/mg。Shrestha等将全长和截短的hEC-SOD基因分别克隆到供体质粒pFastBacHTb,并转染到SF9杆状病毒表达系统,也成功表达出了有活性的全长和截短的hEC-SOD,且Westernblot显示重组hEC-SOD同时以单体(33kD)和二聚体(66kD)形式存在。 昆虫细胞表达系统可以同时表达数个外源基因,在生产蛋白复合体时尤其有效。目前,昆虫表达系统已经广泛应用于疫苗生产和重组病毒杀虫剂等众多领域。但由于鳞翅类昆虫的蛋白加工路径和高等真核生物不同,且杆状病毒感染可能对宿主的蛋白加工具有负面影响,因此其应用还存在一定的限制。 5、哺乳动物细胞表达系统 一般通过质粒转染或病毒载体感染的方法在哺乳动物细胞中表达外源蛋白。利用病毒表达体系可以快速感染细胞,在几天内使外源基因整合到病毒载体中,而利用质粒转染获得稳定的转染细胞则需要几周甚至几个月时间。Lu等采用编码hCu/Zn-SOD和hEC-SOD的两个序列,以及山羊β-酪蛋白的5'端和3'端的调控元件,构建了乳腺特异性表达载体,通过共转染法制备山羊胚胎成纤维细胞作为供体细胞,Westernblot检测显示重组hCu/Zn-SOD和hEC-SOD在转双基因山羊乳腺中均有表达。联合酶联免疫吸附试验(ELISA)显示,重组hCu/Zn-SOD的表达量为100.14mg/L,重组hEC-SOD的表达量为279.10mg/L。酶活性测定结果显示,羊奶中重组hCu/Zn-SOD和hEC-SOD的总生物活性为1451U/ml。这些结果证明了哺乳动物细胞具有生产重组SOD的潜力。 声明:本文所用图片、文字来源《中国食品添加剂》,版权归原作者所有。如涉及作品内容、版权等问题,请与本网联系 相关链接:氧化物,大肠杆菌,毕赤酵母,二聚体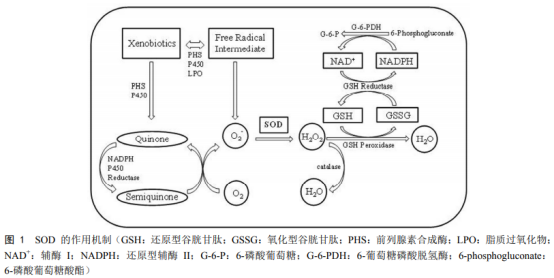
- 最近发表
-
- 海归大熊猫“华美”产仔 英雄母亲生下第9只熊猫宝宝
- 俄羅斯直接燒掉大量天然氣釀巨大環境災難,專家分析:對歐洲挑釁「寧願燒掉也不給你」
- 黃珊珊正式宣佈以無黨籍參選台北市長:「擺脫藍綠惡鬥最好方式,就是讓我當選!」
- 【書評】《破案女神》:犯罪剖繪「是藝術,也是科學」,重新賦予被害者身為人的本來面目
- 当归六黄汤的研究进展(三)
- 《愛迪生傳》:在23歲那一年,愛迪生取得了身為發明家的第一份重要合約
- 「這是個丟失行李箱的夏天」,如何透過追蹤科技確保旅客不再為行李煩惱?
- 《向光植物》李屏瑤 X 曹麗娟對談:年輕時沒有留下時光膠囊,現在只好用文字將它記錄下來
- 美国批准了氟茚唑菌胺杀菌剂的登记注册
- 從「亞細亞孤兒」到國際角力前線,叫好不叫座的「國際新聞」在台灣掀起內容產製熱潮
- 随机阅读
-
- 探究民用机场土质区密实度检测新方法(二)
- 皖藏基层文化交流演出精彩上演
- 中華大學審議委員會認定林智堅論文涉抄襲且情節重大,第2個碩士學位被撤銷
- 【專訪】「教場」系列作者長岡弘樹:我做夢也沒想到會由大名鼎鼎的木村拓哉來飾演風間教官
- 江西:电商平台“点亮”行动成效良好
- 上班沒信心、下班沒動力,「正向管理」三步驟助你有效克服負向成癮迴圈
- 烏克蘭在南部赫爾松展開全面反攻;俄國傘兵逃到法國尋求庇護,揭露「侵烏俄軍幾乎無法作戰」
- 【關鍵眼中盯】吃播也能變公關危機,為什麼蔣萬安被包裝得越來越像連勝文?
- 地下水环境质量评价方法研究(二)
- 越南人落柬埔寨打工陷阱,嫌犯:成功拐一人賺台幣130元
- 39年前韓國貨輪觸礁蘭嶼,近期潛水業者發現沉船油泡滲漏,海保署啟動監控及應變
- 《小小頂級廚師》冠軍朱如茵與偶像江振誠切磋廚藝,10/30起虎航機上能吃到得名料理
- 正己烷中乙烯菌核利溶液标准物质:精准分析助手,高纯标物推荐
- 中華大學審議委員會認定林智堅論文涉抄襲且情節重大,第2個碩士學位被撤銷
- 醉人的「泥煤味」其實很不環保?這兩間酒廠改變釀造流程,讓威士忌變得更「綠」
- 肺癌治療:腫瘤沒有基因突變,標靶藥不管用怎麼辦?
- 小设备破解“大飞机”精密打孔难题
- 雲林縣議員廖郁賢宣布退出時代力量,黨中央回應:人頭黨員、特權疫苗爭議不符公平正義價值
- 三星砸大錢行銷,力拚Z系列折疊機銷量年增50%,民眾購買意願「兩極化」
- 港式酒吧「獅鬥」西門町「重建」觀塘站
- 搜索
-
- 友情链接
-