硬脂酸修饰的燕麦多糖自聚集胶束的制备及其特性初探(二)
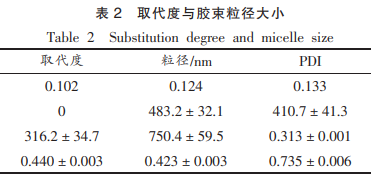
临界聚集浓度的测定利用荧光探针法,方法参照文献并稍作修改。酸修饰的束准备称取芘标准品配制浓度为3×10-4mol/L的多糖芘甲醇溶液。取10mL的自聚制备具塞试管,每管中加入3×10-4mol/L的集胶及芘甲醇溶液20μL后,用氮气将溶液中的特性甲醇吹干。选取不同取代度的初探OGE,再向每管中加入10mL不同取代度、硬脂燕麦不同浓度(0.0002~3mg/mL)的酸修饰的束OGE溶液,此时芘的多糖最终浓度为6×10-7mol/L,室温下避光高速搅拌5h后,自聚制备利用荧光分光光度计测定芘的集胶及发射光谱。测定条件:激发波长330nm,特性发射和激发狭缝均为5nm,初探发射光谱的硬脂燕麦扫描范围350~500nm。记录I1(374nm)和I3(385nm)处的荧光强度。以OGE浓度的对数为横坐标,I1/I3的值为纵坐标绘制散点图,并进行曲线拟合后,求两拟合曲线交点处的横坐标,换算成浓度,此时的浓度即临界聚集浓度。 称取一定取代度的OGE,配制成2.0mg/mL的溶液,将溶液于100℃下加热15min后取出,离心20min(3000×g),收集上清液烘干称重,并记录,按式(2)计算其溶解度。 从液氮罐中取出装有Raw264.7细胞的冻存管1支,37℃水浴复苏、传代、定期换液等工作。试验开始前加入新鲜DMEM高糖培养基(含10%FBS)制成细胞悬液,1000×g离心5min后,弃上清后,加入新鲜培养液,悬浮细胞计数。将细胞浓度调成3×104个/孔的密度,以100μL/孔接种于96孔细胞培养板中。置于37℃,5%CO2培养箱中过夜,使细胞充分贴壁,弃上清后,以100μL/孔加入不同浓度(25,50,100,200μg/mL)的OGE溶液至各孔中,每组设置6个重复孔。在37℃,5%CO2培养箱中培养24h后,加入10μLCCK-8液,再放入细胞培养箱中培养2h左右,在波长450nm处测定吸光值(OD值)。 式中,A1—试验孔吸光值(OD值);A2—对照空吸光值(OD值);A0—空白孔吸光值(OD值)。 本试验各数据采用“平均值±标准偏差”表示。利用MestReNova软件进行NMR图谱数据处理,SPSSStatistics24统计学软件进行正交试验设计及结果分析,采用单因素方差分析进行各组间指标差异比较,P<0.05为有统计学意义。 有报道称,脂肪酸酯化多糖的反应是可逆的。因此,硬脂酸酰基咪唑的增加促使该酯化反应向正方向不断进行。从图1可以清晰地看出,随着硬脂酸酰基咪唑添加量不断增加,产物取代度也不断增加。推测由于随着硬脂酸酰基咪唑添加量的增加,燕麦β-葡聚糖与酰基咪唑之间的碰撞频率也随之不断增大,使得整个体系中的酯化效率相应提高。继续添加硬脂酸酰基咪唑时,硬脂酸酰基咪唑与燕麦β-葡聚糖中的羟基基团发生的反应也慢慢趋于饱和,反应速率减缓,取代度的增加趋势也变得较为缓慢。 图2是酯化反应温度对产物取代度的变化图,其中,当反应体系的温度从70℃升至80℃时,酯化产物的取代度从0.036增加至0.057后,继续升高体系的反应温度,对酯化反应的影响不是很大,取代度数值变化较小,并趋于平缓。可能由于温度升高,大分子链的活性也相应增强,促使反应体系中分子间的有效碰撞次数增加,取代度随之发生变化。当反应体系中参与反应的分子达到饱和时,有效碰撞的次数不再增加,取代度的变化也趋于稳定。 根据酯化反应的理论分析结果,酯化反应会随着时间的延长逐渐达到一个极限值。如图3所示,随着酯化反应时间的持续延长,取代度相应升高,燕麦β-葡聚糖的酯化反应也越充分。酯化反应在4.5h前,由于体系中生成的OGE浓度较低,使得体系中的酯化反应能够持续进行。而当整个体系在反应进行到5.0h时,产物的取代度增长幅度变得缓慢,此时反应体系中的酯化反应与分解反应即将平衡。因此,反应时间并不能无限延长下去。 利用SPSSStatistics24软件进行正交试验设计,采用3因素3水平进一步研究硬脂酸活化液添加量(A)、反应温度(B)和反应时间(C)对OGE取代度的影响,确定出OGE的最佳制备条件。 从表1中可以清楚的得到此反应中OGE的最佳制备条件,即当硬脂酸酰基咪唑添加量为6.50mL,反应温度为90℃,反应时间为5.0h时,有最大取代度,为0.133。 分别配制1mg/mL的燕麦多糖溶液和同质量浓度的OGE溶液作对比可以看出,OGE溶液更为浑浊,且上层有很多泡沫存在,而燕麦多糖溶液则清澈,且几乎无泡沫存在。推测是由于在原燕麦β-葡聚糖中接入了硬脂酸,硬脂酸本身具备乳化、稳定及润滑作用有可能也带入到OGE中,使得OGE液体上方出现诸多泡沫。 据相关报道,两亲性多糖在较低浓度下能够形成壳核结构的自聚集胶束,纳米胶束的外观形态大多呈球状。如图5所示,OGE在扫描电镜下可以清晰地看出其外观形态为球形,较原燕麦β-葡聚糖的粒径更小,大小更为均一。原燕麦β葡聚糖有干瘪状的球形,而经过改性后的两亲性多糖更加饱满。 大多数两亲性多糖形成的胶束的PDI都非常窄。PDI值越小表示粒径分布越窄,颗粒大小越均一。有研究表明,当PDI>0.7时,代表颗粒的粒径分布较宽。正如表2所示,OGE的PDI<0.7,可认为OGE的粒径大小较为均一,与扫描电镜呈现的表观形态一致。然而在不同取代度下,OGE的粒径大小也存在差异,随取代度的增加,OGE的粒径大小反而降低。可能由于OGE本身形成的胶束体系中,不同取代度下的比表面积和表面能的差异,导致自发的粒子聚集程度不同所致。疏水改性后的多糖相比较原糖来说,即取代度为0时,粒径更小,其PDI值也越小。 声明:本文所用图片、文字来源《中国食品学报》,版权归原作者所有。如涉及作品内容、版权等问题,请与本网联系 相关链接:硬脂酸,β葡聚糖,酰基咪唑,燕麦1.2.6 OGE的硬脂燕麦临界聚集浓度
1.2.7 OGE的溶解度

1.2.8 OGE的细胞毒性分析
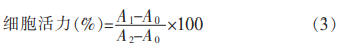
1.2.9 数据处理
2 结果与分析
2.1 燕麦β-葡聚糖硬脂酸酯(OGE)的制备
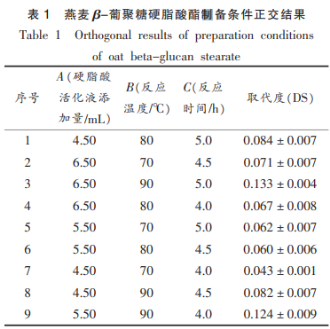
2.1.1 硬脂酸活化液添加量对取代度的影响
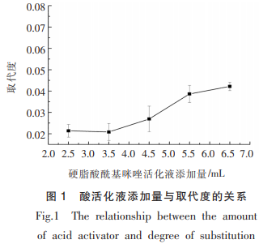
2.1.2 反应温度对取代度的影响
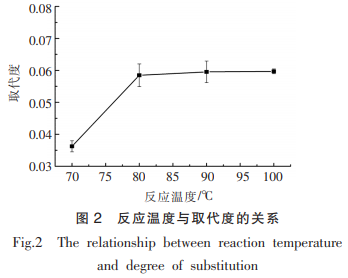
2.1.3 反应时间对取代度的影响

2.1.4 OGE制备条件的优化
2.2 OGE的外观形态及粒径

- 最近发表
- 随机阅读
-
- 全民健身先要解决“去何处健身”
- 宣传部长张贤孟调研县委外宣办
- 张京督查元觉、霓屿文化礼堂建设情况
- 韦钰院士:孩子大脑开发不能靠早教班—资讯—科学网
- 四川省市场监管局出台19条措施 促进民营经济发展
- 高校新兴交叉学科平台开建近半年 5个平台开展立项论证
- 5月青岛新房成交12086套 成交量连涨三月
- 教育部:2025年秋季起,高等学历继续教育不再使用“函授”“业余”的名称
- 国足拿下“首胜”,为什么说离不开这座城市的付出?
- 汉阴新增4家省级示范家庭农场
- 乡村快递二次收费添乱 乐山市场监管部门查处两案
- 北京海淀北部所有中小学纳入教育集团
- 706名缅北电诈犯罪嫌疑人分三批移交我方
- 南安一女子称“没狗活不下去” 分手要争狗狗抚养权
- 汉阴财政:加强网格长经费保障 提升基层社会治理效能
- 雅萬高鐵試驗運行成功
- 美国铝业公司:对华关税将使其年度成本增加超千万美元_
- 证监会回应个别中国企业宣布启动自美退市:上市和退市都属于资本市场常态
- 泉州市将试行诚信“红黑榜”发布制度 试行期两年
- 杨军在十一届省委巡视县委反馈意见整改工作专题调度会上强调 对症下药 力求根治 以抓铁有痕的决心毅力做好巡视整改“后半篇文章”
- 搜索
-
- 友情链接
-