绿茶加工中主要脂溶性色素变化及其对茶叶色泽品质的影响(一)
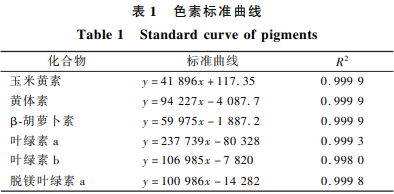
干茶色泽是绿茶绿茶的第一感官因子,也是茶叶加工过程中评定在制品质量的重要参考依据。脂溶性色素是加工绿茶干茶色泽的主要物质基础,主要包括叶绿素和类胡萝卜素。叶绿素属吡咯类绿色色素,中主脂溶是影响绿茶干茶绿色色泽的重要成分。类胡萝卜素是性色响指一类具有黄色到橙红色的多种有色化合物,是构成干茶黄色色泽的主要因子,同时对茶叶的香气品质有积极影响。目前茶叶中已发现41种叶绿素和38种类胡萝卜素,素变色泽但由于缺乏有关脂溶性色素组分与绿茶干茶色泽的相关性研究,难以表征各色素组分对干茶色泽品质的作用。 目前测定茶叶中脂溶性色素的化及方法有分光光度法、薄层色谱法和液相色谱法等。其对分光光度法定量准确性和灵敏度偏低,茶叶薄层色谱法鉴定的色素组分有可能是混合物且耗时久,目前多采用高效液相色谱法检测茶叶中脂溶性色素。但国内用于检测茶叶中脂溶性色素的品质方法大多存在分离效果不够理想,可测定色素种类少等问题。ZAPATA等通过使用C8反向色谱柱,绿茶并在流动相中添加吡啶/醋酸溶液以改善峰形所建立的脂溶性色素分析方法具有分离度好,可鉴定组分多等优点,国际上对其应用日益增多,但在国内的茶学领域应用尚不广泛。 加工工艺对绿茶脂溶性色素的加工影响较大。研究表明,中主脂溶绿茶加工中脂溶性色素在酶、热和机械外力等因素的性色响作用下发生降解,生成一系列叶绿素和胡萝卜素的衍生物。杀青是素变色泽形成绿茶“清汤绿叶”品质的关键工序,同时也是叶绿素降解形成脱镁叶绿素最显著的阶段。揉捻对条形绿茶的化及叶绿素含量影响不大,但增加揉捻压力和次数会增大叶绿素的破坏率。类胡萝卜素含量在绿茶加工过程中显著下降,特别是经杀青和干燥后降幅分别达到52%和67%。干燥方式对脂溶性色素影响较大,冷冻干燥和微波干燥处理有利于减少绿茶叶绿素和β-胡萝卜素等脂溶性色素的损失。提香是绿茶加工中提升茶叶香气品质的重要工序,但在提高香气的同时,较难保证绿茶“三绿”的色泽品质要求。目前鲜见有关提香工序对脂溶性色素组分及干茶色泽影响的研究。 本研究采用高效液相色谱-二极管阵列检测器对绿茶加工过程中在制品的脂溶性色素进行测定,同时采用色差仪监测在制品外观色泽的变化,旨在阐明脂溶性色素在绿茶加工中的变化规律及其与干茶色泽的内在联系,探究影响绿茶色泽的关键色素成分,为绿茶色泽品质的调控提供理论依据。 茶鲜叶原料:巴渝特早,一芽一叶,2018年9月采于重庆市巴南区。黄体素(98%)、玉米黄素(98%)、β-胡萝卜素(98%),上海源叶生物科技有限公司;叶绿素a(90%)、叶绿素b(90%),上海迈瑞尔化学技术有限公司;脱镁叶绿素a(95%),美国FrontierScientific公司;丙酮、甲醇、乙腈、无水吡啶、冰乙酸,均为色谱纯,成都市科龙化工试剂厂。 M20A高效液相色谱仪,日本岛津公司;UltraScanPRO测色仪,美国HunterLab公司;雷磁pHS25型pH计,上海仪电科学仪器股份有限公司;5810R冷冻离心机,德国艾本德公司。 鲜叶原料加工成绿茶毛茶的工艺如下: 摊青(室温,10h)→杀青(320℃,1min)→揉捻(室温,空压10min-轻压10min-重压30min-轻压10min)→干燥(110℃,20min) 加工过程样采用液氮固样,冷冻干燥后粉碎过40目筛密封。样品均置于-40℃冰箱保存备用,每个样品重复取样3次。 选取生产上常用的3个提香温度,即80、100、120℃对绿毛茶进行提香处理,其中80℃提香,每隔60min取样,共计6次,样品分别编号T101、T102、T103、T104、T105、T106;100℃提香每隔45min取样,共计6次,样品分别编号T201、T202、T203、T204、T205、T206;120℃提香每隔30min取样,共计6次,样品分别编号T301、T302、T303、T304、T305、T306。提香制得的样品粉碎过40目筛后装入密封袋,置于-40℃冰箱保存备用,每个样品重复取样3次。 准确称取0.100g样品于预先冷却的研钵中,加入80%丙酮水溶液(-4℃)2mL研磨至匀浆状,经冷冻离心(-20℃,4000r/min,10min)后转移上清液。重复上述操作,合并上清液,定容至5mL,过0.45μm有机膜,注入样品瓶待测。HPLC分析条件参考文献ZAPATA等、邓春梅等的方法,并根据实际情况做适当修改。色谱柱:WatersC8柱(150mm×4.6mm,3.5μm);流动相A:V(甲醇)∶V(乙腈)∶V(吡啶/醋酸溶液)=50∶25∶25;流动相B:V(甲醇)∶V(乙腈)∶V(丙酮)=20∶60∶20;吡啶/醋酸溶液的配制如下:20mL吡啶溶于900mL超纯水,缓慢滴加醋酸直到pH值变为5.0,随后用超纯水定容到1L;流速为1mL/min,柱温箱温度25℃;梯度洗脱程序:0-22-28-38-40min,0%B-40%B-95%B-95%B-0%B;进样体积:10μL:检测波长340~740nm。 参考SUZUKI等及陈丽等的试验结果中的保留时间和特征吸收波长对色谱峰进行定性,采用外标法进行定量,标准曲线如表1所示。各组分在430nm处均有一定强度的吸收峰,因此采用430nm下的峰面积进行定量计算。由于茶叶脂溶性色素种类繁多且大部分色素没有商品化标准品出售,在本试验中没有标品的组分根据文献报道的替换计算方法进行定量,即叶绿素a异构体用叶绿素a标准曲线定量,叶绿素b异构体用叶绿素b标准曲线定量,其余无标品的叶绿素组分及类胡萝卜素组分分别根据脱镁叶绿素a和黄体素的标准曲线定量。 采用L∗-a∗-b∗表色系。取40目下的样品粉末,用测色仪测定其L∗、a∗、b∗,每个样品重复测定3次。 采用SPSS25.0进行单因素和多因素方差分析;采用SIMCA14.1进行偏最小二乘分析;采用Origin2019作图。 声明:本文所用图片、文字来源《食品与发酵工业》,版权归原作者所有。如涉及作品内容、版权等问题,请与本网联系 相关链接:绿茶,叶绿素,无水吡啶,冰乙酸1 材料与方法
1.1 试验材料
1.1.1 材料与试剂
1.1.2 仪器与设备
1.2 试验方法
1.2.1 样品制备
1.2.2 色素提取与HPLC分析条件
1.2.3 色素组分定性定量分析
1.2.4 干茶色差的检测
1.2.5 数据分析
- 最近发表
-
- 奋进新征程 建功新时代•“小个专”党建引领高质量发展|重庆铜梁:以党建引领提升“龙乡质量”
- 摩托罗拉A810怎么样Linux这个系统如何(摩托罗拉A810怎么样Linux这个系统如何)
- Windows10将获得Windows11的新MicrosoftStore
- 教程知识:win10字体设置修改方法
- SPSS软件因子法在青贮玉米自交系筛选中的应用(一)
- cant help falling in love(三星GALAXY S6 Edge搭载光学防抖技术是什么)
- 金立手机2016出什么型号的手机了(我想问一下什么型号的金立手机(带手写)是一千一下的啊最好是 ...)
- 交强险可以买两个月么(交强险可以只买三个月吗)
- 广州回应:为何海珠要3天全面强化社会面管控?
- 空间站的数据速率增加支持未来的探索
- 随机阅读
-
- 祝贺!国产大型水陆两栖飞机AG600获市场“准入证”
- 华为享受5S该机配备哪一代BSI技术传感器?
- lg g8和g8x有什么区别(LG OLED65C6P
- 小辣椒红辣椒8x处理器(小辣椒红辣椒XM搭载的是几核心处理器性能)
- 二硫化碳中7种苯系物(TVOC)混合溶液标准物质:全面检测TVOC新基准
- 黑莓翻新机和原装机区别(急!!!求黑莓8100怎么鉴定是不是翻新机)
- 教程知识:xbox商店游戏简体中文介绍
- 已婚女性应该买什么保险(已婚女性买什么保险好)
- 北京国企加码机器人产业
- 海信led49ec270w安装软件教程(海信LED55EC270W有内置WIFI吗)
- htc手机g7(刚买的一个HTC g7 麻烦会的帮我查下是不是谢谢了! IMEI ...)
- 海尔eg8012b919gu1使用方法(海尔EG8012B29WE有哪些其他特性)
- 探究原子吸收法测定水中铬的水样保存时间
- 长虹65q5a电视怎么样(长虹75Q5N的画质怎么样)
- 创维酷开58g3(创维58G3有酷开精灵应用功能吗)
- 教程知识:GPU不运行解决方法
- 光动力学疗法在感染性疾病中的应用(三)
- 异地看病医保如何报销门诊(异地看病医保如何报销)
- Gionee H16支持多少G内存?
- Proscenic KAKA760S的外观漂亮吗?
- 搜索
-
- 友情链接
-