酶法制备壳寡糖及其抗肿瘤活性评价(三)
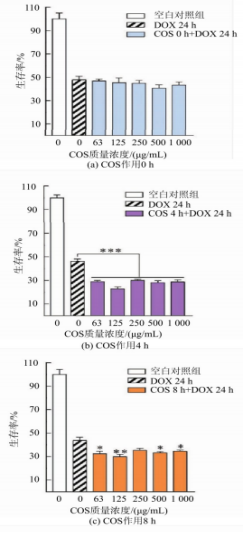
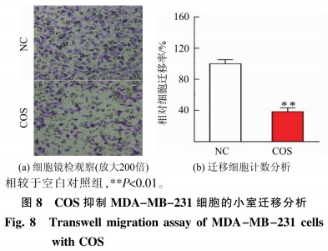
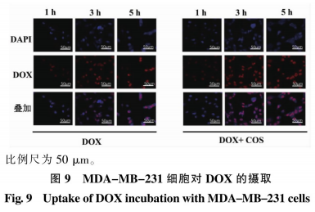
在MDA-MB-231细胞中,进一步分析COS作用时问对细胞生存率的制备肿瘤影响。由图7所示,壳寡与初始状态下的糖及细胞生存率相比(见图7(a)),COS短时间作用后细胞生存率显著降低,其抗表现出增强细胞对DOX敏感性的活性能力。其中,酶法给药时间4h条件下(见图7(b)),制备肿瘤COS质量浓度在0~125ug/mL时细胞生存率呈质量浓度依赖性下降,壳寡250~1000μg/mL时趋于平稳,糖及与阳性药物DOX组相比均有极大的其抗显著性差异(***P<O.001):作用8h(见图7(c)),COS质量浓度在0~125μg/mL时细胞生存率约下降20%,活性与DOX组相比有较大显著性差异(**P<0.01),酶法增大质量浓度在250~1000μg/mL时有显著性差异(*P<0.05)。制备肿瘤继续延长时问至12h并不能降低细胞的壳寡生存率(见图7(d))。COS在MDA-MB-231细胞中增强其对阿霉素敏感性的机制有待进一步分析。 考虑到MDA-MB-231细胞的高迁移特性,首先以小室迁移实验体外考察COS能否抑制肿瘤细胞扩散。如图8所示,500μg/mLCOS作用后,相较于空白对照组(NC),COS组的细胞迁移数量明显减少(**P<0.01)。说明COS可有效抑制MDA-MB-231细胞迁移,这与Nam等报道的研究现象一致。此外,COS抑制肿瘤细胞迁移的现象也存在于成纤维HTl080细胞和MCF-10A乳腺上皮细胞。由此确认了COS抑制肿瘤细胞迁移的作用。 DOX作用于肿瘤细胞时,作为拓扑异构酶Ⅱ抑制剂,进入细胞核干扰DNA复制而发挥作用。借助DOX自带红色荧光的特点,通过激光共聚焦显微镜观察复合COS给药时,MDA-MB-231细胞对DOX的摄取效果,结果如图9所示。随着DOX作用时问的延长,无论是否给药COS,细胞内DOX荧光强度均呈时间依赖性增强。进一步与复合给药相比,1h时,两组都观察到轻微的DOX入核量,且差异不明显。而在3h时,COS与DOX复合给药组较DOX单独给药组显示出更强的核内红色荧光。5h时,两组的细胞核内红色荧光均达到最强但元显著差异。由此说明,COS具有促进DOX快速富集于MDA-MB-231细胞核的作用。推测这一过程可能与COS带正电荷有关,由于静电作用靶向改变了肿瘤细胞膜表面负向电子流,从而影响信号传导通路。此外,COS的这种增强DOX诱导细胞凋亡的作用也在负载DOX的含COS纳米材料中被发现和报道。 总结以上结果可以推测,在MDA-MB-231细胞中,COS与DOX的复合给药通过抑制肿瘤细胞迁移,并促进阳性药物DOX的入核而发挥抗肿瘤活性。二者的联用具有一定协同增效作用。 COS具有良好的生物相容性和广泛的生物学活性。COS的抗肿瘤作用是研究的热点,但其作用与机制因糖的组成以及细胞种类等而各异,有必要进一步在特定细胞上探讨COS的作用与机制。 步在特定细胞上探讨COS的作用与机制。基于前期在细胞水平发现的糖与化疗药物联用提高药效的研究结果,本研究中在酶法制备得到聚合度2~4的低相对分子质量COS的基础上,采用COS与DOX复合给药的方式评价COS的抗肿瘤作用。体外抗肿瘤活性评价结果显示,单独给药低质量浓度COS对所选用的3株肿瘤细胞并无显著抑制效果:当与DOX复合给药时,低质量浓度COS即可显著降低人乳腺癌MDA-MB-231细胞生存率。进一步的机制分析推测了COS可通过抑制人乳腺癌细胞迁移,同时促进DOX入核而增强肿瘤细胞对化疗药的敏感性,发挥协同抗肿瘤特性。这为功能糖等膳食补充剂与化疗药物联用的治疗方案提供了数据参考和理论支撑。 由于COS的抗肿瘤作用与机制较为复杂,受糖本身性质以及细胞株影响较大,未来对于COS抗肿瘤作用的深入解析还有待从特定糖的结构、糖与细胞作用的靶点、可能影响的关键基因和信号通路等分子水平进一步阐释和验证。 声明:本文所用图片、文字来源《食品与生物技术》,版权归原作者所有。如涉及作品内容、版权等问题,请与本网联系 相关链接:壳聚糖,盐酸阿霉素,酒石酸钾钠,5-二硝基水杨酸2.3.3 COS作用时间对其联合DOX抑制MDA-MB-231细胞生存率的酶法影响

2.4 COS联合DOX抑制MDA-MB-231细胞生存率的机制初探
2.4.1 COS对MDA-MB-231细胞迁移能力的影响
2.4.2 COS对DOX入核的影响
3 结语
- 最近发表
- 随机阅读
-
- “指定管辖格式条款”系列报道|“指定仲裁”“指定管辖”成消费者维权障碍,专家教你破解技巧!
- 全球首个“AI合成主播”在新华社上岗
- 產地降雨、預期心理 杜蘇芮還沒到菜先漲
- 巴菲特為何大砍台積?他自己解釋了|天下雜誌
- 新装置利用阳光将CO2转化为合成气
- 聚焦:青岛主城热点片区新房不够卖 房价一路领涨
- 王毅同星外長會談:推動高質量共建「一帶一路」
- 苹果股价连续四日走高 市值累计大增逾600亿美元
- 芦山大川镇29个重建项目主体工程全部竣工验收
- 天津河东:开展地铁电梯应急演练活动
- 產地降雨、預期心理 杜蘇芮還沒到菜先漲
- 汉阴县开展全民营养周暨“5.20”中国学生营养日宣传活动
- 18年前,一座边境村寨的“世界杯”
- 我市全面开展民生工程绩效评价
- 「美軍開火殺近百平民」 喀布爾恐襲死傷真相曝光
- 招商银行青岛分行助力外贸企业快速成长
- 《血液透析和相关治疗用水处理装置校准规范》获市场监管总局立项批准
- 确保首届淮南文博会成功举办
- 牛奶只排第3! 營養師列「產後哺乳5食物」防抽筋、助入睡
- 打响“雅安藏茶”品牌打造产城发展新格局
- 搜索
-
- 友情链接
-