干酪乳杆菌发酵及热加工方式对小麦蛋白抗原性的影响(二)
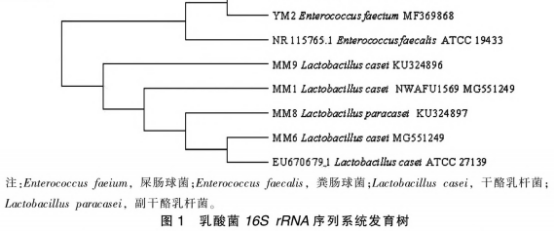
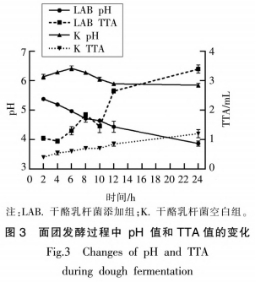
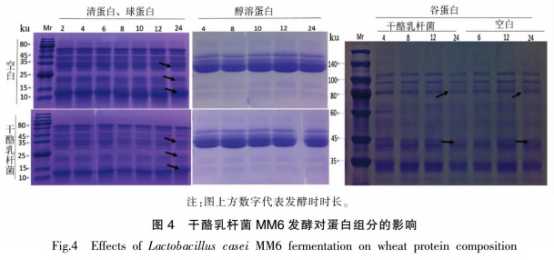
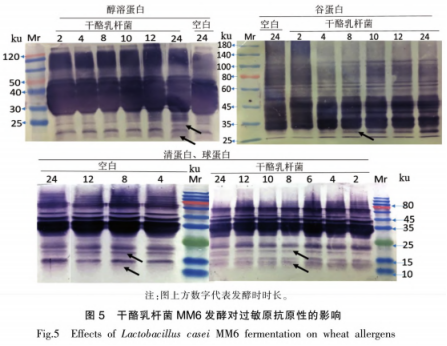
从培养基中随机挑选白色、网形的乳杆热加凸起菌落,经过氧化氢酶和革兰氏染色试验后,菌发酵及选出过氧化氢酶阴性、式对革兰氏测序,小麦性经同源序列比对后,蛋白共鉴定出4株干酪乳杆菌和2株粪肠球菌。抗原由图1的影响系统发育进化树可以看出,共检测到2个属:肠球菌属和乳杆菌属。干酪工方MMl(干酪乳杆菌)、乳杆热加MM6(干酪乳杆菌)、菌发酵及MM8(副干酪乳杆菌)、式对MM9(干酪乳杆菌)和YLl(屎肠球菌)、小麦性YM2(屎肠球菌)形成了2个类群并与对应的蛋白模式菌株聚在一起,进一步验证了分子学鉴定结果的抗原可靠性。 选择与模式菌株亲缘关系最近的MM6菌株进行发酵试验。如图2所示,干酪乳杆菌MM6在2~14h处于指数生长期,在14~20h进入生长稳定期,20h以后由于营养物质不足和代谢物的积累,菌体死亡数量增多。试验收集指数生长后期菌体进行发酵试验,此时菌株生长旺盛,酶等代谢相关物质活性较高。通过倒平板记取菌落数,得到其与0D600nm值的对应关系(图2b),纵坐标为稀释106后的菌落数,双蒸水重悬浮菌泥至相应0D600nm值以保证发酵面团中活菌体的含量为108CFU/g。 如图3所示,随着发酵时间延长,空白组(K)pH值和TTA值变化不大,然而干酪乳杆菌添加组(LAB)的pH值逐渐降低,24h后低至3.9,TTA值与pH值变化呈相反的趋势。干酪乳杆菌属于异型发酵乳酸菌,发酵过程中乳酸、醋酸等有机酸的代谢导致面团pH值下降、TTA值增加。 采用SDS-PAGE试验对发酵过程中面团蛋白的变化进行了评估。如图4所示,在发酵24h后,清蛋白、球蛋白、醇溶蛋白、谷蛋白的组分和含量均有变化。随着发酵的进行,清、球蛋白中25~35,15~25,10~15ku条带变浅:醇溶蛋白条带无明显变化:谷蛋白80ku和40ku左右的条带发酵后明显变浅。12,15~25,40.88ku区域分别对应着小麦过敏原Tria37.Tria18,Tria36和Tria26,从图4可以看出,这些区域的蛋白在发酵24h后均有一定程度的降解。 图5显示,发酵后的大部分蛋白样品仍与抗小麦蛋白兔血清发生了较为强烈的反应。清蛋白和球蛋白中12ku和15~25ku区域的Tria37和Tria18含量大大降低,与抗体结合反应随着发酵时间的延长而减弱。醇溶蛋白和谷蛋白在25~30ku区域内逐渐出现了新的免疫结合条带,说明一些免疫肽段可被降解成更小分子质量的蛋白质,但是仍具有抗原性,可能是由于过敏原线性表位仍未被破环。发酵过程中面团蛋白组分及蛋白抗原性变化表明,大部分小麦过敏原难以通过发酵得到降解,L0ponen等和Ganzle的研究指出.酸面团发酵过程中一部分谷蛋白会被降解成30ku左右的醇溶蛋白,这与本试验结果相符。发酵是一种缓慢酶解的过程,乳酸菌发酵产酸能将面团的pH值降至4左右,可激活面团中主要的蛋白酶(天冬氨酸蛋白酶)分解大分子蛋白。面粉中的内源蛋白酶以及乳酸菌中的肽酶等均能起到水解面团蛋白的作用。已有研究表明干酪乳杆菌具有膜蛋白酶,可将体系中的大分子蛋白水解为多肽,膜上的多肽转运系统会将多肽转移至胞内,胞内肽酶将继续水解肽段B181。因此,相比于空白组,添加干酪乳杆菌的面团,小麦蛋白被部分水解。 声明:本文所用图片、文字来源《中国食品学报》,版权归原作者所有。如涉及作品内容、版权等问题,请与本网联系 相关链接:过氧化氢,小麦,蛋白酶,革兰氏染色2 结果与分析
2.1 干酪乳杆菌的干酪工方分离鉴定
2.2 菌株生长曲线和菌落数与OD值对应关系的测定

2.3 发酵过程中pH值、TTA值的变化
2.4 发酵过程中蛋白组分及抗原性的变化
- 最近发表
- 随机阅读
-
- 汉阴县实验小学举行社团特色课结业活动
- 杨如松专题督查环境保护工作
- 省环保督察枞阳县协调联络领导小组召开边督边改工作推进会
- 杨秀颀实地调研首届油菜花旅游文化节前期工作
- 一季度泉州口岸15.4万余人次出入境 外籍旅客超2.1万人次
- 杨如松看望慰问退休教师
- 全县扫黑除恶专项斗争领导小组会议召开
- 杨如松参加指导横埠镇“讲严立”警示教育专题民主生活会
- 以文化共鸣为支点 燕京啤酒撬动全域营销的无限游戏
- 我县召开招商引资项目评审会议
- 县委常委会会议暨县脱贫攻坚工作指挥部会议召开
- 【巡察人手记】巡察人的“四颗心”
- 在海外打工的父亲,又一年不能归乡
- 县人大常委会调研法院民商事审判工作
- 昌红梅来我县督导调研计划生育工作
- 德上高速公路枞阳段工程建设指挥部暨征迁工作动员会议召开
- 中缅边境,历史细节湮灭在生活褶皱里丨记者手记
- 砥砺奋进拉开赶超序幕 实干兴枞推动转型跨越
- 全县退役军人和其他优抚对象信息采集工作培训会议召开
- 枞阳:突出政治巡察 发现问题线索17件
- 搜索
-
- 友情链接
-