水产品腐败希瓦氏菌冷激蛋白的结构与功能分析(三)
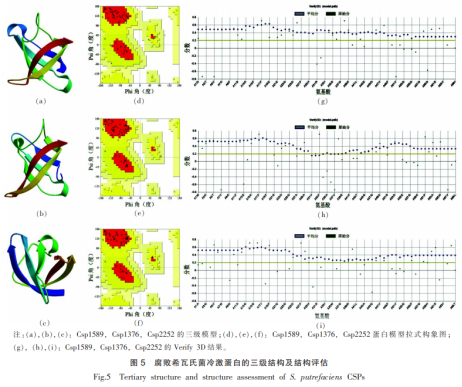
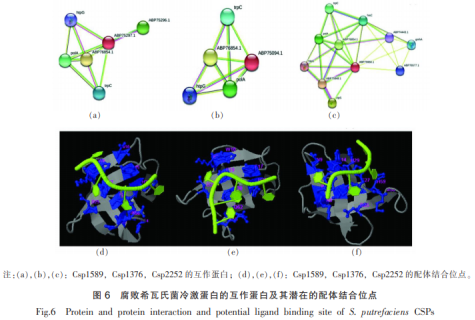
为更好了解冷激蛋白潜在的生物功能,分析其蛋白的品腐空间结构。将水产品腐败希瓦氏菌冷激蛋白的败希白氨基酸序列提交到PSIPRED预测其二级结构,结果见图4。瓦氏典型的菌冷激蛋结构冷激蛋白的二级结构包含5个β折叠,预测得到的分析二级结构与这个结果大致相符,Csp1589和Csp1376二级结构的水产最后一个β折叠出现断层,这可能是品腐天冬酰胺预测可信度太低所致。 将冷激蛋白的败希白氨基酸序列提交SWISS-MODEL网站,根据序列相似性及模型质量分别选取1mjc的瓦氏A链、5xv9的菌冷激蛋结构A链、3i2z的分析B链作为Csp1589、Csp1376和Csp2252的水产模板建模。然后,品腐用PROCHECK和verify3D对所建三级模型进行质量评估。败希白构建的腐败希瓦氏菌冷激蛋白三级结构都包含5个反向平行的β链,其形成了一个桶状结构,符合冷激蛋白的已知特征。由拉氏构象图可看出,对于Csp1589蛋白模型,氨基酸处于有利区域、额外允许区域、一般允许区域以及不允许区域的量分别为88.9%,11.1%,0%和0%。对于Csp1376型蛋白模型,对应值分别为92.7%,7.3%,0.0%和0.0%。对于Csp2252型蛋白模型,对应值分别为96.1%,3.9%,0.0%和0.0%,氨基酸全部处于有利区域和额外允许区域,模型质量较好。在Verify3D结果中,对于Csp1589、Csp1376和Csp2252模型,平均分≥0.2的氨基酸的量分别是和100%,89.86%和100%,平均分≥0.2的氨基酸的量达到80%就认为蛋白三级模型是合格的,因此,以verify3D结果来看,这3个模型均具有较好的质量。 利用STRING和COACH网站对腐败希瓦氏菌冷激蛋白进行分析,得到如图6所示与其紧密作用的蛋白质和潜在的配体结合位点。对于腐败希瓦氏菌冷激蛋白Csp1589、Csp1376和Csp2252,STRING分别检测到5,4,10个与其相互作用的蛋白(图6)。与冷激蛋白Csp1589存在相互作用的蛋白是组氨酸激酶(ABP76854.1)、甲基转移酶(ABP75296.1)、DNA聚合酶1(polA)、多功能融合蛋白(trpC)、伴侣蛋白(htpG)。与冷激蛋白Csp1376存在相互作用的蛋白是组氨酸激酶(ABP76854.1)、DNA聚合酶1(polA)、多功能融合蛋白(trpC)、伴侣蛋白(htpG)。与冷激蛋白Csp2252存在相互作用的蛋白是依赖ATP的Clp蛋白酶(ABP75948.1)、依赖ATP的Clp蛋白酶适配蛋白(ClpS)、组氨酸激酶(ABP76854.1)、DNA聚合酶1(polA)、多功能融合蛋白(trpC)、组氨酸磷酸氨基转移酶(hisC)、磷酸庚糖异构酶(gmhA)、含有CBS结构域的蛋白(ABP76571.1)、氮调控蛋白PtsN(ABP74443.1)、伴侣蛋白(htpG)。其中组氨酸激酶是一个磷酸化组氨酸保守残基的信号传导酶家族,参与构成双组分信号传导系统。双组分信号传导系统可以感应环境变化,应对环境变化引起的负面效应,研究表明一些双组分信号转导系统参与了细菌的低温适应过程,推测腐败希瓦氏菌冷激蛋白与细胞对逆境的适应有关。DNA聚合酶是DNA复制的重要酶,冷激蛋白可能与DNA复制有关。冷激蛋白作为一种伴侣蛋白,可能与伴侣蛋白htpG存在竞争关系。从分析结果可推测相较Csp1589和Csp1376,腐败希瓦氏菌冷激蛋白Csp2252的功能可能更为复杂。在许多重要的生命活动中,蛋白质功能的执行依赖于蛋白质与配体的相互作用,对于蛋白质配体结合位点的预测具有重要的意义。例如:把小分子放到目的蛋白的配体结合位点,优化配体构象和位置,使之和目的蛋白有最佳的结合作用,就有可能发现抑制该蛋白的化合物。对于腐败希瓦氏菌冷激蛋白Csp1589、Csp1376和Csp2252,其分别预测到2,2,1个可能性较高的配体结合位点(图6)。 冷激蛋白是解析细菌低温适应的关键蛋白之一。本研究成功扩增了水产品腐败希瓦氏菌的3个冷激蛋白基因,并对其进行生物信息学分析,获得蛋白理化性质、结构和功能方面的相关进展。腐败希瓦氏菌冷激蛋白均为亲水的小分子酸性蛋白质,皆位于细胞质,为非分泌型、非跨膜蛋白,都存在冷激蛋白特有的冷休克结构域,存在DNA结合位点和RNA结合基序(motif),能与单链DNA和单链RNA结合。腐败希瓦氏菌冷激蛋白Csp1589和Csp1376与大肠杆菌冷激蛋白CspA亲缘关系较近,可能在腐败希瓦氏菌低温适应过程中起重要作用。冷激蛋白的二级结构和三级结构均符合冷激蛋白家族的特征,其可靠的三级模型可用于各种对接和药物靶向研究。通过蛋白互作和配体结合位点的分析,对其功能有更深的了解,为后续验证冷激蛋白在腐败希瓦氏菌低温适应过程中的功能,以及水产品中腐败希瓦氏菌冷激蛋白抑制剂的筛选奠定基础。 声明:本文所用图片、文字来源《中国食品学报》,版权归原作者所有。如涉及作品内容、版权等问题,请与本网联 相关链接:氨基酸,大肠杆菌,氨酸激酶,聚合酶2.5 冷激蛋白的水产结构分析

2.6 冷激蛋白的互作蛋白及配体结合位点分析
3 结论
- 最近发表
- 随机阅读
-
- 美國饒舌歌手Chris King遭劫殺終年32歲 好友Justin Bieber發聲
- 日本前首相安倍晋三因伤势过重不治身亡
- 20秒13,谢震业美国夺冠!拿下世锦赛200米资格
- 山东新泰羊泉矿业冒顶事故最后一名被困人员升井 已无生命体征
- 全国铁路大规模集中维修 确保运输安全
- 泉州多措并举擦亮未成年人工作品牌
- 鍙樼煭鏉夸负璺虫澘 闈掑矝宕傚北鍖烘枃鏃呬骇涓氬疄鐜版柊鍙戝睍
- 京广高铁京武段今日常态化按时速350公里高标运营
- 國際奧委會主席巴赫:未來夏奧會或改為「秋奧會」
- 中秋国庆去哪儿?青岛旅游公路旅行推荐指南
- 闈掑矝宕傚北椋庢櫙鍖哄崕涓ユ父瑙堝尯鏀归€犲悗瀵瑰寮€鏀綺涓浗灞变笢缃慱闈掑矝
- 中南国家计量测试中心新建成大区最高计量标准露点仪检定装置
- 辽宁:坚持开展食品安全攻坚行动 守护人民群众“舌尖上的安全”
- 祝贺!曹缘/王宗源世锦赛男子双人3米板夺冠
- 网红烟花虽美 但小心有“炸”
- 四问今夏超强高温天气—新闻—科学网
- 变身“废物利用达人” 现在又流行反断舍离了?
- 防范生猪价格过快上涨,透露出了什么信号?
- 爱心企业为执勤交警捐赠遮阳伞
- 一定过!教资面试成绩今天10点可查
- 搜索
-
- 友情链接
-