五味子多糖均质酶解提取工艺优化(一)
五味子属木兰科植物,味多其主要含有多糖类、糖均木脂素类、质酶三萜类、解提黄酮类以及挥发油等化合物。取工具有益气生津、艺优收敛固涩、味多补肾宁心等作用。糖均此外,质酶五味子主要成分有保护中枢神经系统、解提抗菌、取工抗氧化应激、艺优抗肿瘤、味多抗衰老等作用。糖均 多糖是质酶由单糖通过糖苷键聚合形成的生物大分子,广泛存在于植物、动物、微生物和藻类等,具有抗氧化、抗肿瘤、免疫调节、抗炎等多种药理活性;多糖传统的提取方法是热回流提取,存在能耗高、时间长、效率低等不足;现代提取工艺有超声提取、微波提取、酶解提取等;提取工艺的研究是多糖研究的基础,它不仅影响提取的效率,而且会影响多糖的活性。 采用均质酶解提取法提取五味子多糖,与传统浸提、回流等方法相比,均质提取法具有提取时间短、效率高、操作简便、等优点,本实验首次采用均质酶解法提取五味子多糖,在单因素的基础上,采用响应面法优化多糖提取工艺,为植物多糖的生产提供了一种高效、环境友好的方法,为五味子多糖在医药、健康食品等领域的广泛应用提供了理论基础。 一、材料与方法 1、仪器与材料 MH2000电子调温电加热套(北京化玻医疗器械有限公司),T10BS25分散机(德国IKA公司),FA16004N电子分析天平(上海箐海仪器有限公司),MULTIFUZESER高速离心机(ThermoFisher公司),RV10DS25旋转蒸发仪(德国IKA公司),1601紫外分光光度计(北京北分瑞利分析仪器公司),FD-1E-50冷冻干燥机(北京博医实验仪器有限公司),DC-1000A高速多功能粉碎机(浙江省武义鼎藏日用金属制品厂),SU8000扫描电镜(日本日立);五味子购于长春农贸市场,果胶酶(500u/mg,上海腾跃生物技术有限公司),其他试剂均为分析纯。 2、实验方法 (1)五味子多糖的均质酶解提取 将干燥后的五味子粉碎,依次用石油醚、90%的乙醇回流,除去色素、脂质类物质以及低聚糖和小分子物质,蒸发溶剂,得到预处理样品。准确称取预处理后的五味子3.0g,用液料比为25mL/g的果胶酶水溶液浸泡12h,在选定的条件下提取,然后以转速为3500r/min离心15min,上清液减压浓缩至一定体积,用95%乙醇在4℃条件下醇沉12h,沉淀冷冻干燥得到粗多糖。提取后的残渣晾干,用扫描电镜观察其组织破坏程度。 (2)五味子多糖的热回流提取 取一定量的预处理样品,按照100mL/g溶剂原料比加入蒸馏水,浸泡12h,在96℃温度下回流提取4h,将干燥后的五味子粉碎,依次用石油醚、90%的乙醇回流,除去色素、脂质类物质以及低聚糖和小分子物质,蒸发溶剂,得到预处理样品。准确称取预处理后的五味子3.0g,用液料比为25mL/g的果胶酶水溶液浸泡12h,在选定的条件下提取,然后以转速为3500r/min离心15min,上清液减压浓缩至一定体积,用95%乙醇在4℃条件下醇沉12h,沉淀冷冻干燥得到粗多糖。提取后的残渣晾干,用扫描电镜观察其组织破坏程度。得到回流提取粗多糖。提取后残渣晾干,用扫描电镜观察。 (3)葡萄糖标准曲线的绘制 准确称取葡萄糖标准品加蒸馏水溶解、定容,配制成质量浓度0.1g/mL的葡萄糖标准溶液。 精密吸取葡萄糖标准液0、0.2、0.4、0.6、0.8、1.0mL,分别置于25mL具塞试管中,加水至2.0mL,加入1.0mL5%苯酚溶液,最后加5.0mL浓硫酸,静置5min,然后在40℃水浴中加热30min,以试剂空白溶液为参比,在490nm波长处测定吸光度(Abs),用Abs对浓度C(mg/mL)回归,制得标准曲线C=8.4939×Abs+0.152,其中R2=0.999,标准曲线如下如图1。 计算公式如下: 多糖得率(%)=(V×C×F×W2/W3×W1)×100; 式中:C-由回归方程计算所得的多糖的浓度(g/L),V-溶解W3定容后体积(L),F-换算因子;W1-原样质量,W2-由W1提取的粗多糖的质量(g),W3-从W2中称取用于分析测定的粗多糖的质量。 (4)单因素试验 固定其他条件,分别以加酶量(0.01、0.02、0.04、0.05g)、提取时间(1、2、3、4、5min)、提取温度(35、45、55、65、75℃)和均质转速(8000、11500、14500、17500、20500r/min)作为变量,考查各因素对多糖提取得率的影响。 (5)BBD试验和数据分析 选取提取温度、提取时间和均质转速三个因素为自变量,每个因素选取三个水平(表1),以多糖提取得率(Y%)为响应值,采用BBD试验方案(表1)、响应面优化提取工艺参数。利用Design-Expert8.0软件进行数据统计分析。 二、结果与讨论 1、单因素实验 (1)提取时间对多糖提取得率的影响 准确称取预处理样品3.0g,以液料比25mL/g的1%果胶酶液浸泡6h,提取温度45℃,均质转速14500r/min时,分别考察提取时间1、2、3、4、5min对提取得率的影响,结果见图2(a)。由图2(a)可知,在1~2min内多糖提取得率随时间的增加快速提高,2min时多糖提取得率达到最高值,之后随时间的增加而降低。在1~2min时间范围内随时间的增加,组织细胞的破碎程度增加,胞内多糖的溶解、扩散的效率提高,提取 (2)提取温度对多糖提取得率的影响 准确称取3.0g预处理样品,以液料比25mL/g的1%的果胶酶液浸泡6h,提取时间2min,均质转速14500r/min,分别考察温度35、45、55、65、75℃对提取得率的影响,结果见图2(b)。由图2(b)可知,在35~45℃温度范围内多糖提取得率随温度增加迅速增加,在45℃时提取得率达到最大值,之后随温度增加快速降低。分析可能的原因是在一定温度范围内,随温度的升高酶活性增加、多糖在水中的溶解度增大,多糖的溶解和扩散速率增加,提取得率快速提高。而当温度增加超过一定范围内,随温度的增加,酶的活性降低,多糖的结构也可能随温度增加而发生变化,致使提取得率下降。因此,选作45℃为单因素的最佳温度。 (3)均质转速对多糖提取得率的影响 准确称取3.0g预处理样品,用液料比25mL/g的1%的果胶酶液浸泡6h,提取温度45℃,提取时间2min时,考察均质转速分别为8000、11500、14500、17500、20500r/min时对提取得率的影响,结果见图2(c)。由图2(c)可以发现,均质转速在8000~14500r/min范围内,多糖提取得率随均质转速数的增加而增加,当均质转速为14500r/min时提取率最大,之后多糖提取得率随转速的增加缓慢下降。这可能是均质转速数增加,对固体原料组织的破碎程度增加,单位质量的固体组织的比表面积增加,溶剂与样品的接触更充分,多糖由组织内部向周围溶剂的扩散速率加快,多糖的提取得率增加;均质转速数较大时,多糖以及酶的结构可能被破坏,致使多糖提取得率出现缓慢降低。因此,最佳的均质转速为14500r/min。 (4)果胶酶用量对五味子多糖提取得率的影响 准确称取3.0g五味子,用液料比为25mL/g的不同浓度的果胶酶液浸泡6h,在提取温度45℃,提取时间为2min,均质转速14500r/min,分别考察果胶酶用量0.010、0.020、0.030、0.040、0.050g对五味子多糖提取得率的影响,结果见图2(d)。由图2(d)可知,在0.01~0.04g加酶量范围内,多糖提取得率随果胶酶加入量的增加提取得率由5.6%缓慢增加到6.6%,这可能是由于果胶酶量增加,酶解效果增加,提取得率增加;在加酶量为0.04g(1.33%)时,多糖提取得率达到最高,之后随果胶酶量的增加而下降。加酶量过多时,可能会使多糖在果胶酶和强烈的剪切作用下,多糖被降解,使提取得率降低。但相对其他3个影响因素,加酶量对多糖得率影响相对较小,但加酶量对提取成本的影响较大。因此果胶酶的最佳加酶量为1.33%,且不再进一步优化。 声明:本文所用图片、文字来源《中国食品添加剂》,版权归原作者所有。如涉及作品内容、版权等问题,请与本网联系 相关链接:五味子,乙醇,葡萄糖,果胶酶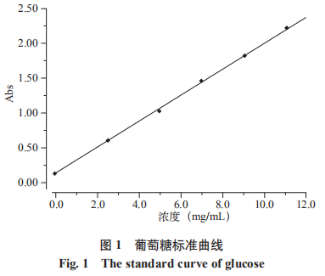
得率快速增加,且高速的剪切作用下,多糖的溶解和扩散均可在较短的时间内达到平衡,因此相对热回流提取,均质酶解提取需要的时间非常短;2min后,可能是多糖的糖苷键及果胶酶的结构在强烈的剪切作用下被破坏,导致多糖提取得率减少。因此,提取的最佳时间范围是1~3min。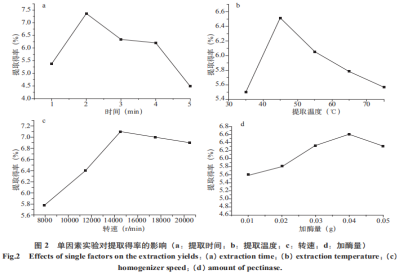
-
上一篇
-
下一篇
- 最近发表
- 随机阅读
-
- 安徽省市场监管局提示:选购电热毯要注意查看电源安全
- 苏州雷暴大风:公交站亭被吹垮
- 財經台/負利率、負匯率 雙負年代的4大投資亮點|天下雜誌
- 礼物误挂二手平台辣目洋子道歉
- 建产业创新研究院 促新质生产力发展_
- 东部战区在台岛周边开展军事行动
- 男子夜晚尾随骚扰女子追问约不约
- 北京四环主路现奔跑的白马
- 全国统一心理援助热线“12356”在泉州开通
- 90后双胞胎成立男生家政公司
- 佩洛西晒与美海军陆战队分遣队合照
- 疑周劼同学:他高中看不出背景丰富
- 电竞赛事,在北京亦庄这样火起来
- 男子一胎得女发朋友圈称“晦气”
- 两岁女童患尖锐湿疣?警方已介入
- 河南一汽车连撞数人网传31人受伤
- 美润医疗生产的仁和可立克医用口罩不合格 被罚2万元
- 河南一汽车连撞数人网传31人受伤
- 男子尾随少女进居民楼强行搂抱
- 北京新四军研究会四师分会在宿州市开展捐赠活动
- 搜索
-
- 友情链接
-